Bioreaktor, inaczej fermentor albo fermentator, to przeważnie zbiornik o pojemności zależnej od zastosowania oraz skali, w jakiej jest realizowany dany proces, generalnie przemysłowej albo badawczej, szklany lub wykonany ze stali nierdzewnej. Oprócz zbiornikowych spotyka się również m.in. fermentory rurowe oraz komorowe.
Specyfika zastosowania tych urządzeń zazwyczaj wymaga, żeby były sterylne i umożliwiały pomiar oraz regulację wielkości kluczowych dla prawidłowego i efektywnego przebiegu zachodzących w nich reakcji. Monitorowane są parametry fizyczne i chemiczne. Jeżeli chodzi o to, jaka konkretnie funkcjonalność i wyposażenie są w fermentatorach standardem, punktem wyjścia do ich prezentacji będzie opis przykładowego procesu w nich przeprowadzanego. W nawiązaniu do aktualnej sytuacji na świecie wybraliśmy produkcję szczepionek.
JAK SIĘ PRODUKUJE SZCZEPIONKI PRZECIW GRYPIE?

Z powodu pandemii koronawirusa tematyka szczepień jest niestety obecnie wszystkim bliższa niż kiedykolwiek wcześniej. Dlatego ani definicji, ani roli szczepionek nie trzeba nikomu wyjaśniać – dla formalności można przypomnieć, że są to preparaty zawierające zarazki, które są wstrzykiwane do organizmu, żeby stymulować jego naturalne mechanizmy obronne. Ma to na celu wytworzenie się w nim trwałej albo czasowej odporności. Drobnoustroje chorobotwórcze są zmodyfikowane w taki sposób, aby nie wywołały u zaszczepionej nimi osoby choroby.
W produkcji szczepionek stosowane są różne metody. Na przykład w przypadku tych przeciwko grypie najpopularniejsze są trzy: z wykorzystaniem jaj kurzych, w ramach hodowli komórkowej w bioreaktorach oraz produkcja szczepionek syntetycznych. Pierwsza, najbardziej rozpowszechniona, jest najstarszą, praktykowaną od lat 40. XX wieku. Proces produkcji praktycznie się od tego czasu nie zmienił.
JAJA I BIOREAKTORY W PRODUKCJI SZCZEPIONEK
Wykorzystuje się w nim zarodki kurze, wstrzykując wirusy do jaj. W nich następuje namnażanie się zarazków. Zreplikowane wirusy są zbierane, oczyszczane, dezaktywowane i używane do produkcji szczepionek. Metoda ta ma wiele wad. Przede wszystkim jest czaso- i pracochłonna, a możliwości pomiarów i sterowania procesem są ograniczone. Ponadto wymaga dużej liczy jaj o odpowiedniej jakości. Proces produkcji jest podatny na zanieczyszczenie. Należy się również liczyć z resztkową alergennością – przez to szczepionki nie można podać osobom z silną reakcją alergiczną na białko jaja kurzego.
Alternatywą jest hodowla komórkowa w fermentorach. W tym przypadku wirus jest wstrzykiwany do komórek, które namnażają się, czemu towarzyszy replikacja zarazków. Te następnie są zbierane, oczyszczane, dezaktywowane i używane do produkcji szczepionek. W porównaniu do "metody z jajami", hodowla komórkowa w bioreaktorach ma wiele zalet.
JAKIE SĄ ZALETY HODOWLI WIRUSÓW W BIOREAKTORACH?
Szczepionka jest dostępna dla alergików. Poza tym odnotowuje się przypadki uzyskiwania większej odporności krzyżowej. Dzięki krótszym cyklom produkcyjnym skraca się czas wprowadzania szczepionki na rynek i zwiększa się wydajność, która nie jest także zależna od ciągłości dostaw ani od jakości surowców.
Łatwiejsze jest skalowanie produkcji, a w przypadku przestoju na tym samym sprzęcie łatwo można zmodyfikować jej profil. Reakcje zachodzące w bioreaktorach są łatwiejsze do opomiarowania oraz sterowania. Znormalizowany proces produkcyjny to też większa sterylność i większa powtarzalność parametrów produktu.
JAK ZMIERZYĆ STĘŻENIE TLENU ROZPUSZCZONEGO?
Hodowla wirusów w fermentorach wymaga ścisłego monitorowania i precyzyjnego kontrolowania warunków, w jakich komórki się namnażają, od nich bowiem zależy jakość szczepionek, czas produkcji i jej wydajność. Chodzi głównie o takie wielkości chemiczne jak: współczynnik pH oraz stężenie rozpuszczonego tlenu (dissolved oxygen, DO) i CO2. Pierwszy ma wpływ na metabolizm oraz szybkość przebiegu reakcji biochemicznych w komórkach. Zawartość CO2 jest wskaźnikiem jakości procesów, które zachodzą w fermentorze, zaś tlen jest potrzebny komórkom do oddychania.
Stężenie tlenu rozpuszczonego w bioreaktorach kontroluje się typowo poprzez regulację natężenia przepływu w instalacji nasycania zawartości zbiornika pęcherzykami powietrza i zwiększanie albo zmniejszanie prędkości obrotów mieszadła. Przeważnie jest to realizowane w układzie regulatora kaskadowego. Jego niezbędną częścią jest sonda do monitorowania stężenia tlenu rozpuszczonego. W pomiarach wartości tej wielkości używane są zasadniczo trzy rodzaje sensorów. Są to czujniki: galwaniczne, polarograficzne oraz optyczne. Różnice w zasadzie działania determinują zalety oraz ograniczenia poszczególnych typów sensorów DO.
CZUJNIKI GALWANICZNE I POLAROGRAFICZNE

Zarówno galwaniczne, jak i polarograficzne czujniki tlenu rozpuszczonego zaliczane są do kategorii sensorów elektrochemicznych. W tego typu czujnikach rozpuszczony tlen dyfunduje z próbki przez przepuszczającą tlen wodoszczelną membranę do komory pomiarowej. W niej zachodzi reakcja chemiczna redukcji i generowany jest sygnał elektryczny. Na podstawie jego pomiaru wyznaczana jest wartość wielkości mierzonej.
Różnica pomiędzy galwanicznymi a polarograficznym sensorami DO polega na tym, że te drugie wymagają przyłożenia zewnętrznego źródła napięcia w celu spolaryzowania elektrod. Czujniki galwaniczne natomiast, ze względu na właściwości materiałowe anody (wykonywanej zazwyczaj z cynku lub ołowiu) i katody (zwykle ze srebra), ulegają autopolaryzacji po zanurzeniu w roztworze elektrolitu (przeważnie wodorotlenku potasu). W konsekwencji sondy polarograficzne wymagają czasu na spolaryzowanie, podczas gdy galwaniczne mogą być używane natychmiast po kalibracji.
CZUJNIKI ELEKTROCHEMICZNE VS. OPTYCZNE
Częścią optycznych sensorów tlenu rozpuszczonego jest źródło światła niebieskiego, które wzbudza membranę pokrytą warstwą fluorescencyjną do emisji światła czerwonego. Pada ono na fotodiodę, która mierzy jego natężenie. To natomiast zależy od stężenia tlenu w komorze pomiarowej.
Typowo galwaniczne i optyczne sondy zapewniają porównywalny poziom dokładności pomiaru. Z drugiej strony w przypadku tych pierwszych występuje zależność od parametrów przepływu próbki w pobliżu membrany – do utrzymania znamionowej dokładności pomiaru wymagana jest jego minimalna prędkość (typowo rzędu kilku cm/s). Takie ograniczenie nie dotyczy sensorów optycznych.
Zaletą galwanicznych czujników jest natomiast krótszy czas odpowiedzi – typowo reagują one na zmianę wartości wielkości mierzonej, w zależności od materiału membrany, nawet do kilku razy szybciej niż optyczne sensory DO. Warto tu jednak zaznaczyć, że czas reakcji zwykle nie jest decydującym parametrem przy wyborze czujnika do ciągłego monitorowania stężenia tlenu rozpuszczonego, jak w przypadku bioreaktorów. Sondy optyczne wymagają rzadszej konserwacji, zaś elektrochemiczne są tańsze.
TEMPERATURA
Oprócz wyżej wymienionych wielkości chemicznych w bioreaktorach mierzonych i regulowanych jest także szereg wielkości fizycznych. Wśród nich są: natężenie przepływu powietrza, natężenie przepływu cieczy, ciśnienie, poziom cieczy i poziom piany, szybkość obrotów mieszadła, lepkość płynu. Poza tym większość procesów, bez względu na ich specyfikę, wymaga pomiaru i regulacji temperatury, wielkość ta ma bowiem zwykle duży wpływ na jakość produktu, szybkość produkcji i koszty operacyjne.
Celem układu regulacji temperatury jest typowo: utrzymywanie jej wartości w określonym zakresie względem wartości zadanej i ograniczenie zużycia mediów. Wymagania te muszą być spełnione w przypadku fermentatorów o działaniu ciągłym, natomiast we wsadowych dodatkowo powinno być zapewnione szybkie i dokładne regulowanie temperatury przy zmianie wartości zadanej i stabilna odpowiedź układu regulacji na zaburzenia, na przykład reakcję egzotermiczną. Żeby te cele osiągnąć, korzysta się z różnych mediów grzewczych i różnych konfiguracji układów regulacji, w tym kaskadowej, o czym piszemy dalej.
PARA WODNA VS. WODA
Do regulacji temperatury w bioreaktorach i ich sterylizacji służą płaszcze grzewczo-chłodzące. Medium przenoszące ciepło to typowo para wodna lub woda. Oba mają zalety, ale i ograniczenia.
W przypadku pary wodnej: precyzja regulacji temperatury jest mniejsza, przepływ energii nie jest jednolity, para o wyższej temperaturze może się gromadzić w górnej części płaszcza, a chłodniejsze skropliny na dnie i występują gorące punkty wokół dysz, co pogłębia problem nierównomiernego ogrzewania produktu. Trzeba korzystać z zaworów do odprowadzania kondensatu (odwadniaczy), które jeżeli są niewłaściwie dobrane albo nieprawidłowo konserwowane, powodują straty energii i spadek dokładności regulacji. Oprócz tego, jeżeli wymagane jest naprzemienne grzanie i chłodzenie szok termiczny w razie zetknięcia się wody chłodzącej z resztkami pary może uszkodzić płaszcz, szczególnie w fermentatorach szklanych.
Jeżeli natomiast medium jest woda: temperaturę można kontrolować z większą precyzją, co wpływa korzystnie na jakość produktu końcowego, ciepło jest przekazywane równomierniej, co zapobiega występowaniu gorących punktów, i możliwe jest płynne przejście z fazy grzania na chłodzenie, bez szoków termicznych. Z drugiej jednak strony woda nie nagrzeje zawartości bioreaktora tak szybko, jak para. W porównaniu do innych mediów zalety wody to z kolei: dostępność, niższa cena, łatwość regulacji przepływu i bezpieczeństwo dla środowiska.
REGULACJA KASKADOWA W BIOREAKTORACH
Celem układu regulacji może być przykładowo utrzymanie zadanej wartości temperatury produktu na wyjściu bioreaktora przez zmianę natężenia przepływu cieczy w płaszczu chłodzącym zbiornika. Na rysunku 1 zostało przedstawione takie rozwiązanie. W tym przypadku w zależności od sygnału sterującego regulowany jest stopień otwarcia zaworu regulującego natężenie przepływu płynu chłodzącego, mierzoną zmienną procesową jest temperatura strumienia wyjściowego, zaś wartością zadaną nastawa tej wielkości. Zaburzenie stanowi natomiast nieznana temperatura cieczy chłodzącej.
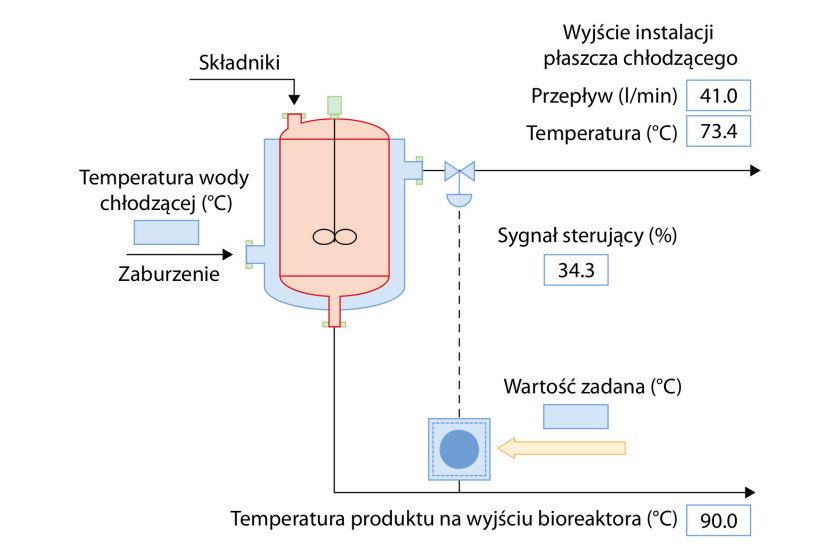
W zależności od stopnia otwarcia zaworu natężenie przepływu czynnika chłodzącego przez płaszcz wzrasta albo maleje. Tym samym zbiornik fermentora jest silniej albo słabiej schładzany. Jeżeli temperatura strumienia wyjściowego bioreaktora jest większa niż ta zadana, sterownik sygnalizuje zaworowi zwiększenie natężenia przepływu chłodziwa o odpowiedni procent. Idealnie powinno to stosownie obniżyć temperaturę produktu na wyjściu fermentora. W praktyce jednak na skuteczność regulacji ma wpływ nieznana i nieuwzględniana temperatura cieczy chłodzącej, która może się znacząco i szybko zmieniać. Jeżeli na przykład temperatura chłodziwa się zwiększy, będzie ono odprowadzać mniej ciepła. Bez zmiany natężenia jego przepływu temperatura strumienia wyjściowego bioreaktora wzrośnie.
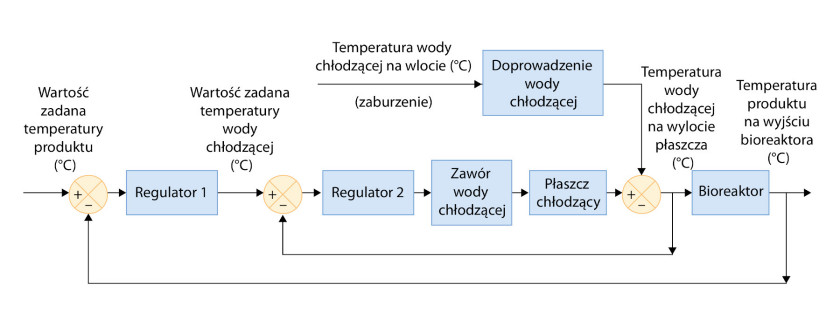
Rozwiązaniem jest układ regulatora kaskadowego (rys. 2). Stanowi on rozszerzenie układu z jedną pętlą sterowania o drugą, w której mierzy się temperaturę chłodziwa. Na podstawie jej porównania z nastawą z regulatora w pętli pierwszej, wyznaczoną w oparciu o pomiar temperatury strumienia na wyjściu fermentatora, zmienia się stopień otwarcia zaworu. Wewnętrzna pętla stanowi niejako system wczesnego ostrzegania o wahaniach temperatury cieczy chłodzącej.
WYPOSAŻENIE DODATKOWE

Oprócz wyżej wspominanych instalacji nasycania zawartości bioreaktora pęcherzykami powietrza i mieszadeł, napędzanych mechanicznie albo, dla zapewnienia sterylności, magnetycznie, których zadaniem jest zapewnienie jednorodności zawartości fermentorów, urządzenia te są wyposażone w szereg innych elementów wykonawczych. Wśród nich są pompy oraz zawory. Służą one do doprowadzania składników produktów, a ostatnie także do pobierania ich próbek do badań.
Pompy z kolei dozują ponadto środki antypienne. Pienienie się jest poważnym problemem w bioreaktorach, zwłaszcza gdy się nasila. Obniża ono bowiem ich pojemność użytkową, utrudnia pomiary, prowadzi do nagromadzania się osadów na ściankach i może spowodować skażenie materiału w zbiorniku w przypadku wniknięcia piany do układu wentylacji. Oprócz środków chemicznych zmniejszających pienienie się fermentory wyposaża się w mechaniczne rozbijacze piany.
Monika Jaworowska













