Chirurgia małoinwazyjna to technika wykonywania operacji medycznych, która różni się od podejścia tradycyjnego tym, że chirurg operuje narzędziami wprowadzanymi do ciała pacjenta przez małe, typowo krótsze niż 1 cm, nacięcia. Inaczej niż podczas zwykłych operacji, gdy powłoki ciała są rozcinane i otwierane, nie ma on więc bezpośredniego dostępu do organów, a jedynie zdalny podgląd na nie, poza narzędziami chirurgicznymi przez jedno z tych nacięć jest bowiem wprowadzany także wziernik z kamerą. Technika ta ma wiele zalet z punktu widzenia pacjentów. Są to: mniejsza utrata krwi, mniejsze ryzyko zakażenia, mniejszy ból po operacji, krótszy pobyt w szpitalu, szybszy powrót do aktywności, mniejsze, mniej szpecące blizny. Z perspektywy lekarzy natomiast zabiegi takie stanowią dużo większe wyzwanie niż tradycyjne.
Wyzwania chirurgii małoinwazyjnej
Przede wszystkim chirurg musi liczyć się z pogorszeniem się koordynacji wzrokowo-ruchowej. Ograniczone pole widzenia wziernika utrudnia orientację. Niełatwe jest również operowanie narzędziami, którymi manipuluje się względem wejścia prowadnicy umieszczonej w ciele – lekarz powinien uwzględniać ograniczenia w zakresie liczby stopni swobody ruchu, jego skalowania, przełożenia prędkości. Operowanie utrudnia też brak sprzężenia dotykowego. Chirurg nie może zbadać ciała pacjenta palcami, aby wyczuć rozmiar, kształt, twardość, położenie danego organu, ani nie odczuwa oporu tkanek przy ich nacinaniu, czego niestety podgląd nie jest w stanie w pełni zrekompensować. Ergonomia stanowisk, na których przeprowadza się takie zabiegi, także nie jest najlepsza – dyskomfort jest tym większy, im dłuższa i bardziej skomplikowana jest dana operacja. Wszystko to razem sprawia, że w chirurgii małoinwazyjnej od lat na znaczeniu zyskują roboty.
Zapewniają one dokładność pozycjonowania nieosiągalną przez ludzi – można je precyzyjnie nakierować na punkt docelowy i są w stanie utrzymywać zadaną trajektorię na całym odcinku. Ludzie nie dorównują im również pod względem powtarzalności ruchów ani zręczności. Systemy sterowania robotów przeskalowują ruchy dłoni. Ponadto odfiltrowują naturalne drżenie zmęczonych rąk, zmniejszając ryzyko błędów. Dzięki temu, że sprawniej operują w ograniczonej przestrzeni i przy utrudnionym dostępie do organów, zabiegi można wykonywać przez mniejsze nacięcia.
Roboty chirurgiczne
Wyróżnić można kilka kategorii tytułowych maszyn. Do jednej z nich zaliczane są te w pełni zautomatyzowane, w których chirurg pełni funkcję nadzorczą. Jego zadaniem jest też zaplanowanie zabiegu – w tym celu, wykorzystując różne metody obrazowania medycznego (RTG, USG, itp.), wyznacza punkty i odcinki na ciele pacjenta oraz sekwencje ruchów. Te są odwzorowywane w modelu 3D, na którym później opiera się robot. Chirurg ustawia również narzędzia w pozycji wyjściowej. Tego rodzaju roboty wykorzystuje się w mniej skomplikowanych zabiegach, jak operacje ortopedyczne, w których maszyna przykładowo jedynie przycina kości na wymiary implantu.
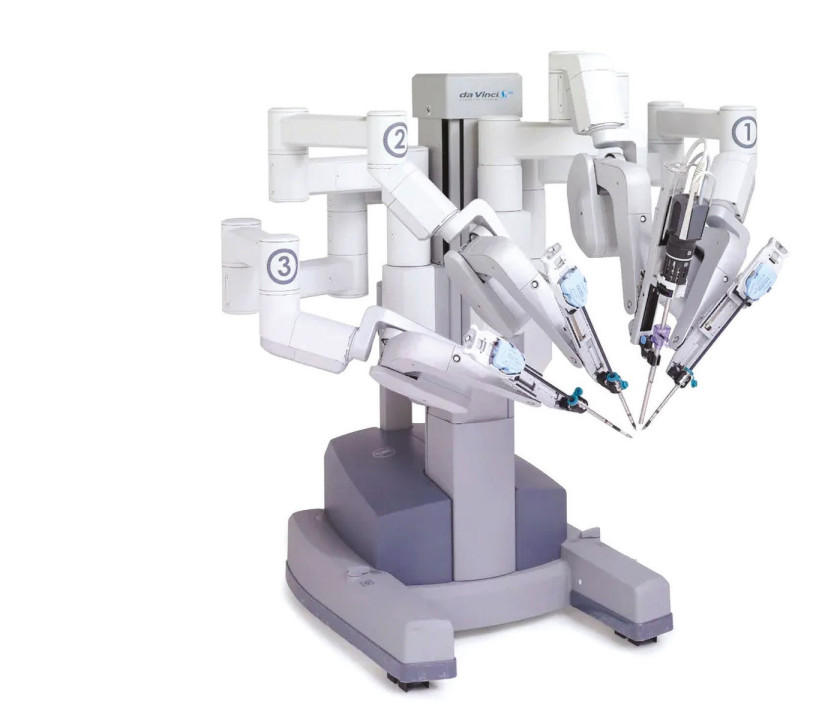
Najpopularniejszą kategorią robotów chirurgicznych są te, którymi chirurg steruje na odległość. Zdalne operacje są zazwyczaj wykonywane przez lekarzy, którzy znajdują się w tej samej sali co robot i pacjent, chociaż przeprowadza się także próbne zabiegi, w czasie których lekarz steruje maszyną przez Internet. W ich przypadku należy się liczyć z dodatkowymi problemami, które wyniknąć mogą z opóźnień i przerw w transmisji albo ograniczonej przepustowości łącza.
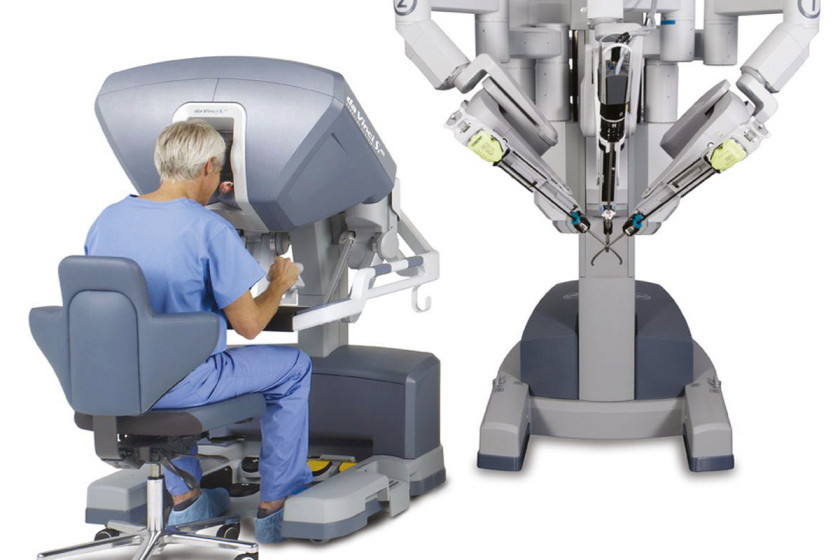
Do tej grupy zalicza się obecnie najczęściej wykorzystywany model robota chirurgicznego da Vinci. Jego podstawowe komponenty to: konsola, zapewniająca chirurgowi podgląd obrazu wnętrza ciała pacjenta z systemu wizyjnego 3D, za pośrednictwem której steruje robotem z przeważnie czterema albo trzema ramionami, z których jedno manipuluje kamerą endoskopową, natomiast pozostałe narzędziami naśladującymi ruchy dłoni i nadgarstka lekarza. Ograniczeniem robotów da Vinci jest brak sprzężenia dotykowego. Wynika ono z wyzwań, z jakimi wiąże się implementacja tej funkcjonalności.
Sprzężenie dotykowe – lista wyzwań
Przede wszystkim w tym zastosowaniu precyzja pomiaru siły oraz momentu obrotowego ma kluczowe znaczenie, a wszelkie interferencje między poszczególnymi osiami ruchu muszą być wyeliminowane albo skompensowane, podobnie jak inne zakłócenia (na skutek tarcia narzędzi w prowadnicy, oporu jam ciała). Niestety ze względu na ograniczenia przestrzenne kompensacja różnicowa z wykorzystaniem wielu czujników jest trudna.
Oprócz złożoności pomiaru wielkości, których wartości są potrzebne do odwzorowania wrażenia dotyku, analizy wymaga miejsce wbudowania sensorów. Rozważane są zasadniczo dwie lokalizacje. W pierwszej czujnik byłby umieszczony poza ciałem pacjenta, na wejściu prowadnicy, przez którą wprowadzane są narzędzia, a w drugiej zostałby wbudowany w końcówkę narzędzia, co oznacza, że byłby razem z nim wprowadzany do ciała. Oba podejścia mają zalety i wady, wybór lokalizacji bowiem wpływa na precyzję pomiaru, ograniczenia w zakresie wielkości elementu pomiarowego, możliwości sterylizacji oraz wymogi dotyczące zgodności biologicznej materiału jego wykonania.
Gdzie umieścić czujnik siły?
Umieszczenie w końcówce narzędzia wiąże się z większym kosztem i utrudnieniami w zakresie wielokrotnego używania sensora, w związku z tym, że jego konstrukcja musiałaby być odporna na wielokrotne cykle mycia i sterylizacji, zachowując przy tym hermetyczność. Ze względu na to, że generalnie dąży się do tego, aby minimalizować nacięcia, którymi wprowadza się narzędzie, czujnik powinien być na tyle mały, żeby przez nie bezproblemowo przeszedł. Redukuje to rozmiary elementu pomiarowego do poniżej 10 mm.
Jeżeli natomiast sensor miałby znajdować się na wejściu prowadnicy, wówczas należy się liczyć z zafałszowaniem wyników pomiarów. W takim przypadku bowiem siły kontaktowe tkanek mogłyby być maskowane przez m.in.: tarcie narzędzi w prowadnicy i na jej wlocie, na złączach narzędzi, czy siłę chwytu manipulatora. Z drugiej jednak strony, ponieważ element pomiarowy pozostawałby na zewnątrz ciała, wymagania w zakresie jego rozmiarów i biokompatybilności materiałów wykonania nie byłyby już tak ostre. Nie musiałby być także poddawany tak często sterylizacji, a jedynie na przykład dezynfekcji.
Prace nad dotykowym sprzężeniem zwrotnym w robotach chirurgicznych trwają. Przewiduje się, że gdy w końcu uda się je zrealizować na satysfakcjonującym poziomie, nastąpi szybka popularyzacja chirurgii zrobotyzowanej. Oprócz tego, że stanowić będzie olbrzymie ułatwienie dla lekarzy, którzy przeprowadzają zabieg w zakresie oceny struktur anatomicznych oraz świadomości wykonywanych na nich działań, haptyczne sprzężenie zwrotne odegra też fundamentalną rolę w skrócaniu krzywej uczenia się podczas szkoleń z obsługi takich robotów. Dane zebrane z czujników siły pomogą poza tym w tworzeniu dokładnych modeli tkanek i narządów do symulatorów chirurgicznych.
Czy jest alternatywa dla metali?
Branża robotów chirurgicznych, podobnie jak sprzętu medycznego, generalnie stara się dla swoich specyficznych potrzeb w jak największym stopniu adaptować najnowocześniejsze technologie materiałowe i innowacyjne rozwiązania w tym zakresie. Przykładowo już od dawna można obserwować tendencję do zastępowania metali tworzywami sztucznymi. Ma to na celu zmniejszenie wagi i obniżenie kosztów, co z kolei sprawi, że bardziej opłacalne będą komponenty jednorazowego użytku, ułatwiające zapobieganie zakażeniom szpitalnym. Tworzywa sztuczne zapewniają również większą swobodę projektowania w porównaniu z metalami.
Przez dziesięciolecia metal był jednak preferowanym materiałem nie bez powodu. Przede wszystkim konwencjonalne tworzywa sztuczne nie były w stanie zapewnić właściwości mechanicznych, trwałości ani stabilności wymiarowej na porównywalnym poziomie. W chirurgii zrobotyzowanej wymagana jest również biokompatybilność materiału oraz jego odporność na bardzo wysokie temperatury i poddawanie wielokrotnym cyklom czyszczenia, dezynfekcji i sterylizacji. Ostatnio tworzywa sztucznych pod tymi względami zaczynają jednak dorównywać metalom.
Polimery specjalne nadzieją chirurgii zrobotyzowanej
Ogromne oczekiwania pokłada się zwłaszcza w polimerach specjalnych. Nie tylko bowiem stanowią alternatywę dla metali, ale mogą też zastępować inne tworzywa sztuczne, z których dotychczas wykonywano podzespoły sprzętu medycznego. Przykład to polisulfon (PSU), który może być wielokrotnie sterylizowany parą ze względu na jego wyższą odporność na ciepło oraz stabilność hydrolityczną w porównaniu z poliwęglanem, który szybko traci swoje właściwości udarowe po wielokrotnej sterylizacji parą. Inny polimer, polifenylosulfon (PPSU), natomiast zachowuje swoją wyjątkową twardość i udarność nawet po tysiącu cykli dezynfekcji oraz sterylizacji parą, przewyższając polieteroimid (PEI), wykazujący pogorszenie właściwości fizycznych już po stu cyklach. PPSU jest poza tym odporny na popularne roztwory myjące i szpitalne środki dezynfekujące.
Do polimerów specjalnych zalicza się również polieteroeteroketon (PEEK) i poliarylamid z dodatkami (PARA). PEEK wyróżnia się, łącząc odporność chemiczną i zmęczeniową, dobre właściwości mechaniczne oraz wyjątkową stabilność wymiarową. Wielokrotne czyszczenie, dezynfekcja, sterylizacja parą praktycznie nie mają na ten materiał wpływu. Ponadto dodatki włókna szklanego i włókna węglowego zwiększają jego wytrzymałość i odporność na zużycie.
Poliarylamid z dodatkiem włókna szklanego z kolei charakteryzuje wytrzymałość, sztywność i odporność na sterylizację oraz wysoka jakość wykończenia powierzchni, co czyni go szczególnie atrakcyjnym w zastosowaniach, w których estetyka jest ważna. Poza tym tworzywa PPSU, PEEK i PARA spełniają wymagania ISO 10993-1, międzynarodowej normy regulującej biologiczną ocenę wyrobów medycznych. Z wymienionych polimerów specjalistycznych wykonywane są narzędzia chirurgiczne, połączenia między narzędziami chirurgicznymi i ramionami robotów chirurgicznych oraz ich obudowy.
Wyzwania sterylizacji
Ręczne elektronarzędzia chirurgiczne są używane w zasadzie we wszystkich specjalnościach medycznych – korzysta się z nich podczas operacji m.in. ortopedycznych, laryngologicznych, neurologicznych, okulistycznych. Zastępują one coraz częściej narzędzia pneumatyczne, ze względu na większą wydajność, lepszą kontrolę mocy, cichszą pracę, przenośność i łatwość zasilania (wystarczy gniazdko lub akumulator, zamiast zazwyczaj bardziej problematycznego podłączenia do systemu zasilania powietrzem).
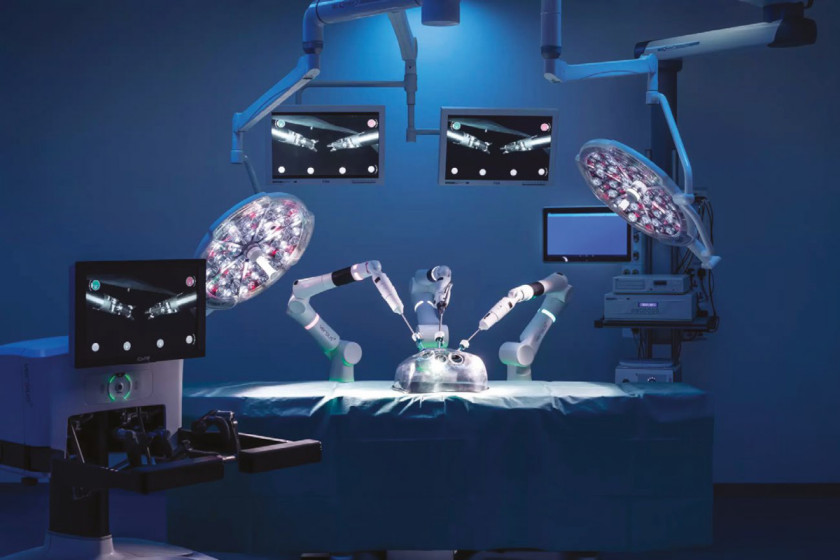
W projektowaniu ręcznych elektronarzędzi na potrzeby chirurgii i narzędzi, którymi posługują się roboty chirurgiczne, wyzwaniem jest konstrukcja ich napędu – chodzi głównie o to, by zastosowany silnik charakteryzował się wytrzymałością, kompaktowością, a przede wszystkim odpornością na powtarzające się cykle sterylizacji, na poziomach wymaganych w tego rodzaju urządzeniach. Trudne jest zwłaszcza spełnienie ostatniego warunku z powodu ekstremalnie uciążliwych czynników, na które silnik jest narażony w procesie odkażania.
Najpopularniejszą metodą sterylizacji stosowaną w szpitalach jest autoklawowanie (sterylizacja parowa). Przeprowadza się je w hermetycznym, podgrzewanym zbiorniku, wyposażonym zwykle także w pompę próżniową. Cykl sterylizacji typowo obejmuje: opróżnienie autoklawu z powietrza, wypełnienie zbiornika parą wodną pod ciśnieniem, odkażanie w takich warunkach, zazwyczaj przez kilkanaście–kilkadziesiąt minut i końcowe schładzanie. Takie czynniki, przede wszystkim zawilgocenie i temperatura, oczywiście nie wpływają korzystnie na trwałość silników elektrycznych, szczególnie jeżeli się powtarzają. Trudności z tym związane próbuje się rozwiązywać na kilka sposobów.
Silniki w sterylizowanych narzędziach
Jednym z nich jest korzystanie z elektronarzędzi jednorazowych. Aby ograniczyć koszty, wyposaża się je w tani silnik, oszczędza się też na materiałach wykonania pozostałych podzespołów. Mimo to elektronarzędzia, które trzeba wyrzucić po zabiegu, nie są ekonomiczną opcją, zwłaszcza jeżeli operacje, w których się ich używa, są często wykonywane. Zwiększają również ilość odpadów niebezpiecznych, które wymagają specjalnych rozwiązań w zakresie magazynowania, odbioru i utylizacji.
W innym stosowanym podejściu przed oddaniem elektronarzędzi do sterylizacji personel ma za zadanie wyjąć z nich blok silnika. Wynikają z tego liczne komplikacje. Przede wszystkim potem, podczas wkładania niesterylnego silnika do wysterylizowanego elektronarzędzia pracownicy muszą przestrzegać specjalnych procedur. Poza tym w związku z tym, że silnik nie został odkażony, mogą się pojawiać wątpliwości co do sterylności elektronarzędzia. Dodatkowo nie można uniknąć sytuacji, w których personel zapomni wyjąć silnik przed włożeniem do autoklawu, co zwykle skutkuje jego awarią.
Kolejnym rozwiązaniem jest zabezpieczenie silnika na stałe wbudowanego w elektronarzędzie dodatkowymi uszczelnieniami, które mają uniemożliwić jego zawilgocenie. Konsekwencją tego przeważnie jest duża, nieporęczna konstrukcja, a oprócz tego nadmiarowe uszczelnienia na wale mogą pogorszyć wydajność silnika, zwiększyć opory ruchu, a przez to podnieść pobór prądu i powodować przegrzewanie się. Co więcej, liczyć się trzeba z tym, że takie zabezpieczenie, jak każde uszczelnienie, z czasem straci na skuteczności.
Silniki autoklawowalne
Najlepszą opcją jest użycie autoklawowalnego silnika – w takiej wersji dostępne są na przykład bezszczotkowe silniki prądu stałego. W tym zastosowaniu lepiej sprawdzają się silniki BLDC żłobkowe, które ze względu na konstrukcję są z założenia lepiej chronione przed wpływem czynników zewnętrznych. Takie silniki mają bowiem uzwojenie umieszczone w żłobkach wewnątrz statora, inaczej niż bezżłobkowe, które mają tylko płytki w kształcie pierścienia, pozbawione żelaznego rdzenia, pełniące funkcję statora. Wprawdzie silniki bezżłobkowe też można zabezpieczyć, stosując na przykład powłoki ochronne, zazwyczaj zabezpieczenie to nie jest tak trwałe, jak w przypadku konstrukcji żłobkowej. Dlatego sprawdzają się głównie wtedy, gdy nie będą sterylizowane zbyt często.
Na koniec warto dodać, że czasem stosuje się też pokrowce ochronne. Umieszcza się w nich elektronarzędzia, a w przypadku robotów chirurgicznych przykrywa się nimi manipulatory. Przeważnie osłona taka jest wykonana z tworzywa sztucznego i przeznaczona do użytku jednorazowego. Dzięki pokrowcowi elektronarzędzie bądź ramię robota są izolowane od czynników skażających, co eliminuje konieczność ich sterylizowania. Takie podejście jest powszechne w przypadku rozbudowanych chirurgicznych systemów zrobotyzowanych, gdyż autoklawowanie całego takiego stanowiska jest niepraktyczne.
Monika Jaworowska














