Korozja polega na nieodwracalnym uszkodzeniu powierzchni metalu. Jest to skutek zachodzących na niej reakcji chemicznych i elektrochemicznych. Zwykle korozja ma charakter elektrochemiczny. W takim przypadku, żeby do niej doszło, potrzebne są metal, elektrolit (wystarczy nawet cienka warstwa wilgoci na powierzchni metalu) oraz tlen. Można w niej wyróżnić dwie reakcje cząstkowe: rozpuszczanie metalu (utlenianie, reakcja anodowa) i redukcję tlenu (reakcja katodowa). Zachodzą jednocześnie, prowadząc do równomiernych uszkodzeń, albo oddzielnie i miejscowo, powodując lokalne ubytki.
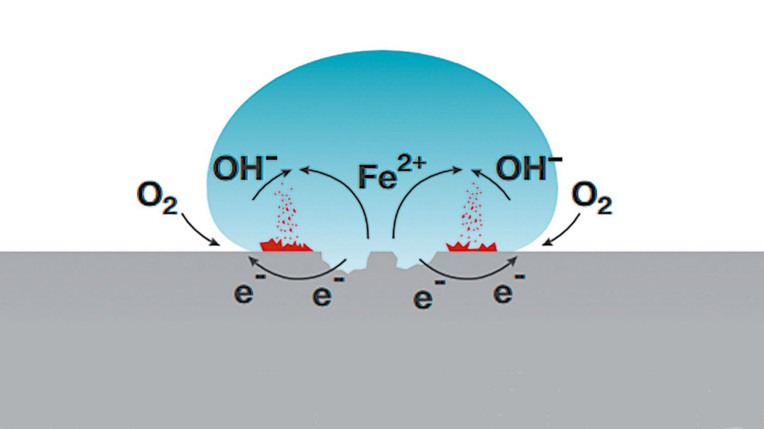
Na rys. 1 zobrazowano mechanizm korozji żelaza pod wpływem wody. Zachodzą w tym przypadku zarówno reakcja rozpuszczenia metalu (Fe → Fe ²⁺ + 2e⁻), jak i redukcji tlenu (O2 + 2H2O + 4e⁻ → 4OH⁻). Ich produkty (jony Fe ²⁺ i jony OH⁻) reagują w kropli wody, tworząc rdzę. Podobny przebieg ma korozja innych metali.
Formy korozji
Uszkodzenia korozyjne mogą mieć różną formę. Jeśli reakcje cząstkowe zachodzą jednocześnie, na całej powierzchni dochodzi do mniej lub bardziej równomiernego rozpuszczania metalu i tworzenia się produktów korozji – rdzy. Ma to miejsce np. w przypadku niezabezpieczonej stali w warunkach atmosferycznych. W praktyce jednak rzadko ubytki są idealnie jednorodne – zwykle niektóre obszary metalu korodują szybciej niż inne. To prowadzi do powstawania miejscami bardziej lub mniej szorstkiej powierzchni, nierównomiernie pokrytej produktami korozji.
Wżery to zlokalizowana forma korozji. Występuje głównie na metalach z powłoką pasywną. Do takich zaliczane są: aluminium, tytan i stal nierdzewna, których odporność na korozję wynika z obecności na ich powierzchni cienkiej warstwy tlenku. Proces inicjujący korozję zaczyna się w ich przypadku od miejscowego zniszczenia powłoki pasywnej, przykładowo na stali nierdzewnej przez jony chlorkowe. Na rys. 2 pokazano etapy tego procesu.
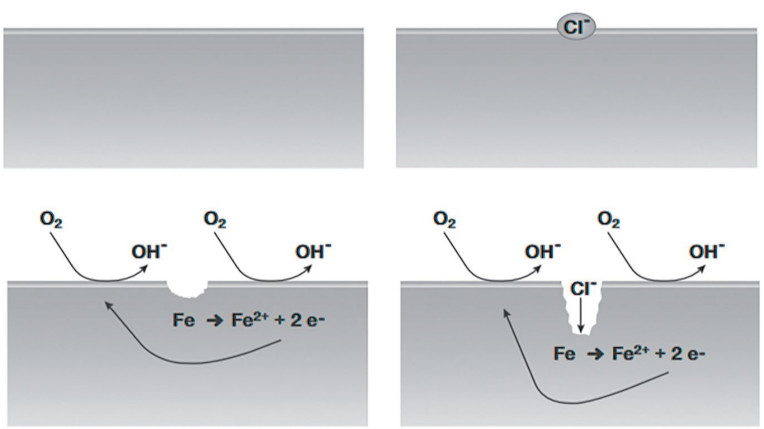
Wżery, choć punktowe, mogą się okazać większym problemem niż korozja jednorodna. Wynika to stąd, że ta druga jest zwykle wyraźnie widoczna na powierzchni, podczas gdy wżery, w przypadku których nie wiadomo, ile materiału pod powierzchnią już uległo uszkodzeniu, są trudniejsze do wykrycia.
Korozja szczelinowa
Korozja rozwija się też w szczelinach, między powierzchniami wykonanymi z tego samego metalu, różnych metali, a nawet metalu i niemetalu. Jest inicjowana przez ograniczony dopływ powietrza. Prowadzi to do różnic stężeń rozpuszczonego tlenu w elektrolicie, co skutkuje powstaniem ogniwa elektrochemicznego. W efekcie, na różnych częściach powierzchni, zachodzą reakcje cząstkowe – na zewnątrz, tam gdzie stężenie tlenu łatwo dostępnego z powietrza jest większe, ma miejsce jego redukcja, natomiast w szczelinie dochodzi do rozpuszczenia metalu i powstania lokalnych wżerów. Korozja szczelinowa zachodzi np. pod podkładkami śrub, jeżeli dostanie się tam woda. O tym, czy wystąpi, decydują warunki otoczenia i szerokość szczeliny – jeśli jest zbyt wąska, elektrolit tam nie wpłynie, jeżeli za szeroka, tlen będzie mógł do niej swobodnie wnikać.
Korozja może być również skutkiem połączonego wpływu czynników mechanicznych oraz reakcji elektrochemicznych. Przykładowo, jeśli zostanie zainicjowana przez działanie chlorków na warstwie pasywnej stali nierdzewnej, czego skutkiem będzie niewielki wżer, z upływem czasu pod wpływem naprężeń (przykładanych lub szczątkowych) w materiale będzie się on powiększał, aż przekształci się w pęknięcie. To odsłoni aktywną (niepasywną) powierzchnię metalu, która łatwo skoroduje. To z kolei prowadzi do dalszego propagowania pęknięcia i odsłaniania kolejnych podatnych na korozję powierzchni w głąb materiału.

Korozja galwaniczna
Wyróżnia się też korozję naprężeniową indukowaną wodorem. Jest ona spowodowana obecnością tego gazu w strukturze krystalicznej metalu, co osłabia jego integralność, stopniowo prowadząc do wzrostu jego kruchości. Źródłem wodoru bywa proces produkcyjny (wytwarzanie stali, trawienie, elektrocynkowanie), ale może on też być produktem korozji i wtórnie dyfundować do materiału.
Korozja międzykrystaliczna to natomiast szczególna forma korozji zlokalizowanej, która rozwija się w konkretnym obszarze, zazwyczaj wzdłuż granic ziaren w strukturze metalu. Najczęstszym jej efektem jest szybka mechaniczna dezintegracja (utrata plastyczności) materiału.
Korozja galwaniczna z kolei występuje, gdy istnieje różnica potencjałów pomiędzy dwoma różnymi metalami zanurzonymi w elektrolicie. Wówczas reakcja cząstkowa, anodowe rozpuszczanie metalu, zachodzi prawie wyłącznie w jednym z nich. Zwykle bardziej reaktywny metal, który pełni funkcję anody, ulega rozpuszczeniu, a ten mniej reaktywny nie jest atakowany przez korozję, służąc jedynie jako katoda dla redukcji tlenu. Przykładowo, w połączeniu cynk–miedź, Zn działa jako anoda, a Cu jako katoda. W rezultacie zniszczeniu ulegnie głównie cynk.
Ochrona przed korozją
Działania tego rodzaju podejmuje się przeważnie już na etapie projektu, a ochrona przed korozją obejmuje jej zapobieganie i zmniejszanie skutków. Celem jest w tym przypadku głównie ograniczenie możliwości gromadzenia się wody oraz zanieczyszczeń, które stanowić będą środowisko korozyjne, i izolowanie metali, których zetknięcie się skutkowałoby korozją galwaniczną.
Ważny jest również odpowiedni dobór materiałów. W tym celu ich odporność na korozję analizuje się pod kątem czynników środowiskowych, na które mogą być w danym zastosowaniu narażone, i sposobu ich użytkowania.
Kolejnym sposobem jest wpływanie na środowisko korozyjne w taki sposób, aby zmniejszyć jego agresywność. Obejmuje to szereg działań, w tym wprowadzenie do środowiska czynników, które hamują korozję, usunięcie tych sprzyjających jej rozwojowi, np. przez osuszanie powietrza z wykorzystaniem absorbentów wilgoci, oraz zmianę warunków eksploatacyjnych, jak temperatura czy pH. Spowolnienie postępu korozji zapewniają jej inhibitory.

Inhibitory korozji
Inhibitorami są substancje chemiczne i ich mieszanki, które dodane w bardzo niskich stężeniach do środowiska korozyjnego skutecznie zapobiegają korozji lub ją hamują, zarazem nie wchodząc z nim w większą reakcję. Są to związki organiczne i nieorganiczne, w postaci stałej, ciekłej albo gazowej, zwykle rozpuszczalne, popularne szczególnie w systemach zamkniętych, w których łatwo o utrzymanie ich właściwego stężenia. Przykładem – układy recyrkulacji wody chłodzącej. Ze względu na mechanizm działania inhibitory dzieli się na anodowe, katodowe i mieszane.
Anodowe (pasywujące) tworzą trudno rozpuszczalne związki z nowo powstałymi jonami metalu. Są one adsorbowane na powierzchni anody, tworząc ochronną powłokę, która zwiększa jej potencjał. To spowalnia reakcję korozyjną. Wyróżnić można dwa rodzaje inhibitorów pasywujących: aniony utleniające (jak chromiany, azotyny, azotany), tworzące barierę ochronną w warunkach braku tlenu, i jony nieutleniające (jak fosforany, wolframiany i molibdeniany), które wymagają obecności tlenu. Niestety, inhibitory anodowe, gdy ich stężenie spada poniżej minimalnej wartości, same mogą powodować korozję wżerową. Dlatego konieczne jest jego monitorowanie.
Inhibitory katodowe z kolei hamują korozję przez spowalnianie szybkości reakcji redukcji. Działają na trzy sposoby: utrudniając rekombinację wodoru, wytrącając się w postaci tlenków, które tworzą ochronną warstwę (np. wapń, magnez) i reagując z tlenem (np. arsen i antymon w środowiskach kwaśnych podczas rozpuszczania żelaza). Inhibitory mieszane natomiast spowalniają zarówno procesy anodowe, jak i katodowe.
Kolejnym kryterium klasyfikacji inhibitorów jest typ środowiska korozyjnego. W kwaśnym wykorzystywane są m.in. związki nieorganiczne, jak tlenki arsenu i antymonu oraz organiczne aminy, aldehydy, alkaloidy. Inhibitory w środowisku zasadowym to m.in. tiomocznik, fenole, naftol. Ważną grupę stanowią tzw. zielone inhibitory pochodzenia naturalnego, które wyróżnia biodegradowalność. W zależności od sposobu aplikacji wyróżnić można z kolei inhibitory: dodawane do elektrolitu, powłok ochronnych, smarów i lotne (odparowujące).

Ochrona anodowa i katodowa
Ochrona katodowa polega na obniżeniu potencjału metalu, co zapobiega jego rozpuszczaniu. Z kolei anodowa – na zwiększaniu potencjału aż do wartości, przy której metal ulegnie utlenieniu (pasywacji), pokrywając się zabezpieczającą powłoką tlenkową. W tych celach w obu przypadkach wykorzystuje się zewnętrzne źródło prądu. Przykładem techniki ochrony anodowej jest anodowanie aluminium.
Proces ten zwiększa naturalną odporność na korozję cechującą ten metal, a jednocześnie poprawia jakość wykończenia powierzchni wykonanych z niego detali. Anodowanie w porównaniu do innych technik ochrony i poprawy wyglądu aluminium wyróżnia się tym, że nie wymaga jego powlekania dodatkowym materiałem. Dzięki temu więc, że jest to w dalszym ciągu w 100% czyste aluminium, również w 100% nadaje się do recyklingu.
Anodowanie polega na podłączeniu źródła prądu do obwodu katody i anody, którą jest element z aluminium – obu zanurzonych w elektrolicie. W rezultacie anoda jest powlekana ochronną warstwą tlenku. Grubość powłoki zależy od tego, jak długo w tym obwodzie płynie prąd. Anodowane aluminium ma matowe, srebrne wykończenie, można jednak dodać barwniki, aby uzyskać określony kolor powierzchni zabezpieczonej przed korozją.
Powłoki ochronne
Ochronę anodową i katodową można także zrealizować w inny sposób – przez powleczenie metalu powłoką o odpowiednio wyższym lub niższym potencjale. Przykładowo, w drugim przypadku metal bazowy (chroniony), narażony na korozję, jest pokrywany metalem (protektorem), który będzie korodował zamiast niego. Warstwę ochronną, pełniącą w takim układzie funkcję anody, wykonuje się z metalu bardziej reaktywnego (mniej szlachetnego) niż ten bazowy. Podejście to ma jednak istotne wady. Przede wszystkim, w związku ze stratą materiału anody, która następuje z czasem, powłoki trzeba okresowo odnawiać. Problem może również stanowić zanieczyszczenie środowiska produktami korozji metalu protektora.
Przykład powłoki anodowej to warstwa cynku nałożona na stal. Powłoki ochronne z tego materiału można nakładać na kilka sposobów. Takim jest elektrogalwanizacja. W procesie tym prąd płynie przez roztwór wodny zawierający jony cynku, co prowadzi do osadzania się metalicznego cynku na podłożu stalowym. Przed tym etapem powlekane elementy są czyszczone i trawione, co ma na celu usunięcie zanieczyszczeń mogących zmniejszyć przyczepność warstwy ochronnej. Po osadzeniu cynku wykonuje się jeszcze proces pasywacji. Elektrogalwanizacja to preferowana metoda ochrony np. małych elementów gwintowanych, ponieważ w ten sposób można uzyskać cienkie, jednorodne, szczelne powłoki.

Cynk nakłada się także przez zanurzenie elementów stalowych w kąpieli z roztopionego Zn. W ten sposób powleka się głównie większe elementy, uzyskując grubsze warstwy ochronne. Wykorzystuje się też proces termiczny. W takim przypadku elementy stalowe umieszcza się w bębnie z proszkiem cynkowym, a potem ogrzewa się go do temperatury przekraczającej +300°C. Powłoka formuje się na skutek dyfuzji termicznej proszku cynkowego w stal.
Poza powłokami metalicznymi ochronę przed korodowaniem zapewniają też m.in. farby z dodatkami inhibitorów korozji. Popularnym sposobem ich nanoszenia jest technika malowania proszkowego. W metodzie tej naelektryzowane cząstki farby osadzają się na uziemionym obiekcie. Ten następnie nagrzewa się do wysokiej temperatury, rzędu kilkuset °C. Wówczas proszek topi się, polimeryzuje, a potem utwardza, tworząc powłokę malarską.
Monika Jaworowska













