Współczynnik pH oblicza się jako ujemny logarytm ze stężenia molowego jonów wodoru. Dlatego jego nazwa stanowi połączenie symboli, matematycznego przypisanego ujemnemu logarytmowi (p) i chemicznego oznaczającego wodór (H). Wyrażany jest wartością w skali od 0 do 14 – na przykład roztwory z 10^–8 i 10^–2 molami jonów wodoru na litr mają wartości pH odpowiednio 8 i 2. Roztwory o małym pH, w przedziale od 0 do 6, są klasyfikowane jako kwasowe, zaś te o pH w zakresie od 8 do 14 jako roztwory o odczynie zasadowym. Środkowa wartość skali, czyli pH 7, charakteryzuje chemicznie czystą wodę o odczynie obojętnym. Ze względu na logarytmiczny charakter tego współczynnika nawet pozornie małe zmiany pH znacząco zmieniają właściwości roztworu. Na przykład spadek pH z 6 na 5 oznacza aż dziesięciokrotny wzrost stężenia kwasu, a zmiana o zaledwie 0,3 jego podwojenie.
Współczynnik pH to jeden z częściej mierzonych parametrów procesowych w wielu gałęziach przemysłu, w tym w farmaceutycznej, rolnictwie, oczyszczaniu ścieków i przede wszystkim w produkcji żywności i napojów. Prawidłowa wartość pH w tej ostatniej gwarantuje, że wyroby mają spójne właściwości, jak smak, zapach, kolor, konsystencja i trwałość, są bezpieczne dla konsumentów, spełniają wymagania prawne.
pH w przemyśle spożywczym
Przykładowo pH świeżego, surowego mleka powinno mieścić się w przedziale od 6,4 do 6,8. Wartość tego współczynnika zależy od zawartości kwasu mlekowego, który jest wytwarzany przez mikroorganizmy. Im jest większa, tym ma większy wpływ na smak i zapach mleka, a oprócz tego może wskazywać na chorobę krów; pH sprawdza się też w produkcji sera oraz śmietany. Wpływa na przykład na to, czy ser będzie miękki; czy twardy. Poza tym jeśli pH pozostaje w zakresie od 4,1 do 5,3 wolniej namnażają się w nim bakterie. Z kolei w procesie produkcji jogurtu mleko schładza się dopiero po uzyskaniu kwasowości 4,4 – 4,6. Ponadto odczyn wsadu owocowego musi być taki sam jak jogurtu. Gotowy powinien mieć pH 4,0‒4,4 dla dłuższej trwałości. Jeżeli w produkcji używana jest woda komunalna, często się ją uzdatnia. To też wymaga kontroli pH. W produkcji soków owocowych sprawdzany jest z kolei odczyn ekstraktów cukrowych i soków podczas ich oczyszczania. Wartość pH odgrywa też ważną rolę w produkcji piwa. Na przykład w przypadku słodu kruszonego wynosi 5,8, podczas gdy najlepsza wartość pH dla rozkładu białka to 5,5. Kontroluje się także pH warzonego piwa przed i po butelkowaniu. Odczyn wina zwykle wynosi od 2,8 do 3,8. Wartość pH ma wpływ na proces fermentacji, smak wina, jego trwałość – powyżej 3,5 mogą się w nim już zacząć rozwijać bakterie. Wartość pH wody myjącej jest natomiast wskaźnikiem czy owoce morza zostały dobrze umyte. Optymalny odczyn chleba, który zapewni maksymalne wydłużenie jego przydatności do spożycia, mieści się w przedziale 4‒5,8. Ciasto do jego wypieku powinno być zakwaszone do wartości pH 4,1 lub niższej, by mieć pewność, że nie będą się w nim namnażać bakterie – w przeciwnym razie trzeba je przechowywać w temperaturze nieprzekraczającej 5°C. Optymalny odczyn marmolad i syropów to 3,5. Wartość pH mierzy się także podczas żelowania dżemów. Produkty pasteryzowane i sałatki na zimno mają zwykle odczyn 5,3. By wydłużyć ich trwałość dodaje się do nich ocet, sok z cytryny, majonez, co obniża pH do 4,1.
Czym mierzyć pH?
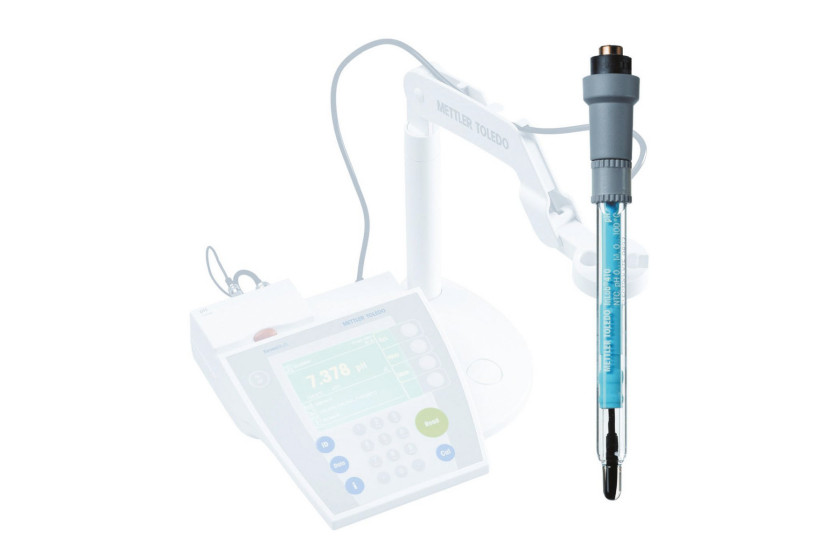
Istnieje kilka sposobów pomiaru pH, które różnią się pod względem dokładności. Jedną z opcji jest użycie paska lakmusowego. Jest to kawałek papieru, który został pokryty sproszkowaną substancją, która w kontakcie z roztworem zmienia kolor w zależności od jego odczynu. Metoda ta, chociaż jest szybka, nie gwarantuje poziomu dokładności wymaganego w zastosowaniach przemysłowych. Poza tym pozwala jedynie na dyskretne odczyty, nie umożliwiając ciągłego pomiaru zmian wartości pH, który jest wymagany dla jej skutecznej regulacji. Alternatywą spełniającą te wymogi są pH-metry. Miernik tego typu składa się z woltomierza, do którego podłączono elektrodę jonoselektywną i elektrodę odniesienia. Elektrody mają postać szklanych rurek, wypełnionych odpowiednio roztworem obojętnym oraz elektrolitem. Obudowa elektrody pomiarowej jest wykonana z porowatego, przepuszczalnego szkła. W obu szklanych rurkach umieszczone są srebrne druty. Po zanurzeniu elektrody pomiarowej w mierzonym roztworze przez jej obudowę przenikają jony. Kierunek ich ruchu zależy od jego odczynu. Powoduje to przepływ prądu w obwodzie zamykającym się przez wewnętrzne roztwory elektrod, mierzony roztwór, druty i pH-metr, mierzący różnicę między potencjałami, stałym elektrody odniesienia i zmiennym elektrody pomiarowej. Technologia wykonania elektrod w pH-metrach na przestrzeni lat nie zmieniła się znacząco, a jedynie była wciąż udoskonalana przez wprowadzanie różnych konfiguracji. Najpopularniejszym typem są elektrody kombinowane, w których elektrody pomiarowa i odniesienia umieszczone są w jednym korpusie. Są one dostępne w różnych wersjach, zarówno do zastosowań laboratoryjnych, jak i przemysłowych. Pierwsze wyróżnia mniej odporna obudowa, zwykle plastikowa. Sprawdzają się w laboratoriach oraz testowaniu próbek. W wersji przemysłowej są zabezpieczone trwałym korpusem, co pozwala na ich montaż bezpośrednio w zbiorniku lub rurociągu. Są również wyposażone w przyłącza procesowe, co umożliwia ciągłe monitorowanie pH. Dostępne są też czujniki w wersji różnicowej. Składają się z trzech elektrod: pomiarowej, odniesienia i uziemiającej. Dzięki temu zapewniają dokładny odczyt nawet w razie wystąpienia zakłóceń i sprawdzają się w trudnych warunkach, w przemyśle i w pomiarach odczynu ścieków.
Jak uniknąć błędnych wskazań?
Wykonane ze szkła elektrody czujników pH są podatne na stłuczenie. Z czasem sensory te zużywają się, ponieważ zmienia się porowatość szklanej rurki elektrody jonoselektywnej – na ich żywotność wpływa sposób magazynowania (nieużywane elektrody też się starzeją), konserwacji i użytkowania (ważne są właściwości mierzonych roztworów). Dlatego wymagana jest regularna kalibracja. Ponieważ na pomiar pH ma wpływ temperatura, jest to kompensowane w przyrządzie pomiarowym (ręcznie, automatycznie). To, czy należy zastosować kompensację temperaturową, zależy od wymaganej dokładności odczytu. Można też popełnić kilka błędów, które pogarszają dokładność i wiarygodność pomiarów. Takim jest niewłaściwie przechowywanie. Najczęstszym błędem jest magazynowanie bez nawodnienia elektrod, co powoduje wysychanie tej pomiarowej. Wynika to stąd, że jej rurka jest wykonana ze szkła składającego się z trzech warstw: uwodnionej zewnętrznej żelu szklanego, suchej środkowej i uwodnionej wewnętrznej. Dlatego bez kontaktu z płynem wysycha. Skutkuje to błędami pomiarowymi, spadkiem czułości, długim czasem pomiaru. Na szczęście nie jest to zwykle trwałe uszkodzenie – wystarczy elektrodę nawodnić, skalibrować i znów nadaje się do użytku. Kolejnym błędem jest przecieranie elektrod ręcznikiem papierowym, by usunąć z nich zanieczyszczenia, gdyż powoduje to wytworzenie się ładunków elektrostatycznych zakłócających odczyt napięcia na elektrodach. Zamiast tego wystarczy przepłukać elektrodę wodą destylowaną albo dejonizowaną i jeżeli jest to konieczne, za pomocą ręcznika papierowego usunąć nadmiar wilgoci, pamiętając aby nim jej nie pocierać. Nie wolno jednak przetrzymywać elektrod w wodzie dejonizowanej ani destylowanej, zamiast w specjalnym płynie do tego przeznaczonym, ponieważ na skutek braku równowagi jonowej powoduje to wypływ jonów z roztworów elektrod, czyniąc je bezużytecznymi. Nie należy też zapominać, że czyszczenie elektrod (specjalnie do tego przeznaczonymi roztworami) jest równie ważne, jak ich regularna kalibracja. Kolejny problem to niewłaściwie dobrane elektrody – innego typu wymagają na przykład próbki półstałe, roztwory z cząstkami zawieszonymi czy te o małej przewodności. Źródłami błędów pomiarowych mogą być także zbyt niski poziom wypełnienia elektrod, za płytkie zanurzenie sondy pomiarowej w badanej próbce, użycie zużytej elektrody.

Monika Jaworowska













